quimica
QUÍMICA
saul lucasReacciones químicas
Una reacción química se produce cuando las sustancias participantes en ella se transforman en otras distintas. A las primeras se les llama reactivos y a las segundas productos. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva. Esto sucede porque sólo se lleva a cabo un reordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlaces.
Antes de comenzar el estudio de las reacciones químicas es necesario que observes la simbología usada para expresar de una forma sencilla y universal una reacción química. Para ello haz clic en el siguiente vínculo:
Clasificación general de las reacciones químicas
Una ecuación química es una forma resumida de expresar, mediante símbolos y fórmulas, una reacción química. En ella determinamos las sustancias reaccionantes, se predicen los productos y se indican las proporciones de las sustancias que participan en la reacción.
Para identificar si ha ocurrido una reacción química es necesario verificar si se ha dado alguno de los siguientes eventos:
Se produce una efervescencia (producción de gases).
Se libera o absorbe energía (cambia la temperatura del matraz o recipiente donde ocurre la reacción).
Cambio de color de los reactivos participantes.
Aparece un precipitado o sustancia insoluble.
En esta tabla aparecen los símbolos más utilizados en las ecuaciones químicas. Observa que las sustancias que actúan como reactivos se escriben del lado izquierdo de la reacción mientras que los productos (sustancias que se forman durante una reacción química) del lado derecho.
Símbolos de uso común en las ecuaciones químicas (Hein, 1992)
Símbolo Significado
Dan o producen (apunta hacia los productos).
Reacción reversible; equilibrio entre reactivos y productos.
Gas que se desprende (se coloca después de la sustancia).
Sólido o precipitado que se forma (se coloca después de la sustancia).
(s) Estado sólido (se coloca después de la sustancia).
(l) Estado líquido (se coloca después de la sustancia).
(g) Estado gaseoso (se coloca después de la sustancia).
(ac) Solución acuosa (sustancia disuelta en agua, se escribe después de ella).
Δ Energía calorífica.
Más o se agrega a (al aparecer este signo entre dos sustancias).
Para escribir una ecuación química se tiene que tomar en cuenta que:
Debemos saber cómo reaccionan las sustancias y qué nuevos productos se forman.
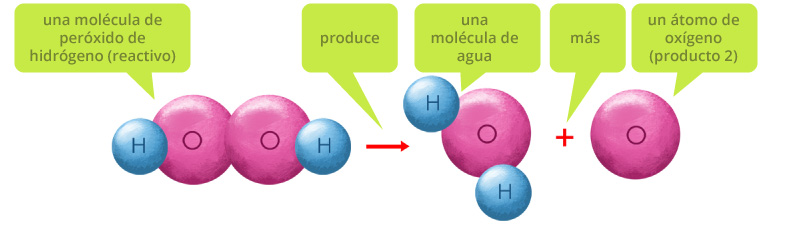
Toda ecuación química debe estar balanceada, es decir que debe de existir la misma cantidad de átomos de un mismo elemento de ambos lados de la ecuación química, por ejemplo, esta es una representación de una molécula de agua oxigenada o peróxido de hidrógeno (H2O2).
Agua oxigenada
El agua oxigenada es un líquido transparente muy reactivo, por lo que se utiliza como desinfectante y bactericida. Por este motivo se requiere almacenarlo en recipientes color ámbar, que no permitan la entrada de luz y de esta manera el agua oxigenada almacenada no reaccione ni se descomponga.
El agua oxigenada por acción de la luz reacciona descomponiéndose en agua y oxígeno. Esta reacción se produce de la siguiente manera:

Comentarios
Publicar un comentario